Publié le 01 déc 2020Lecture 9 min
Infections humaines à poxvirus
G. BOHELAY, T-A. DUONG
Certains poxvirus sont bien connus du fait de leur éradication (variole) ou de leur fréquence dans les populations pédiatriques (molluscum contagiosum). Les deux dernières décennies ont été marquées par la description de nouveaux parapoxvirus, aux manifestations proches de l’orf, et par les orthopoxvirus, virus émergents aux manifestations proches de la variole, présents sur la liste des agents pathogènes à haut risque selon l’OMS, du fait de l’augmentation des cas décrits en zone d’endémie et de cas rapportés aux USA et en Europe.
Les poxvirus sont responsables d’infections humaines où prédominent les manifestations cutanées, mettant le dermatologue au premier plan de la prise en charge. Certains sont connus de tous du fait de leur caractère historique ou de leur fréquence. D’autres sont plus rares, mais responsables de tableaux cliniques proches de la variole. Dans le contexte de baisse de l’immunité antivariolique et de mondialisation des transports, les récentes épidémies de monkeypox virus (MPXV) ont récemment renforcé l’attention portée aux orthopoxvirus (OPXV), un genre de poxvirus considéré comme émergent ; les autorités sanitaires craignant de nouvelles épidémies et leur export hors de zones d’endémies du fait des modifications des modes de vie, ainsi que le risque de réintroduction accidentelle ou intentionnelle pour la variole.
Virologie et répartition mondiale
Les poxvirus (PXV) sont les plus grands virus infectant les animaux. Ces virus encapsulés à ADN bicaténaire ont une réplication cytoplasmique. Parmi les poxviridæ, seuls 4 genres de la sous-famille des chordopoxvirinæ infectent l’homme : les orthopoxvirus (OPXV), les molluscipoxvirus (MCPXV), les parapoxvirus (PPXV) et les yatapoxvirus (tableau 1). Étant donné leur tropisme pour les revêtements épithéliaux, ils sont à l’origine d’irruptions pustuleuses chez les mammifères (« pox », i.e. pustule). Leur transmission se fait par contact rapproché avec un hôte infecté, par contact direct avec une plaie infectée, ou par voie aéroportée pour les OPXV, et plus rarement indirectement par contact avec des fomites. Leur répartition géographique dépend de la répartition des hôtes réservoirs respectifs (tableau 1). Seuls 2 PXV ont un réservoir humain, la variole et le molluscum contagiosum virus (MCV) ; PXV le plus fréquemment rencontré en pratique clinique. Les autres poxviroses sont des anthropozoonoses responsables de cas isolés ou de petites épidémies touchant un groupe occupationnel ou des populations vivant dans certains biotopes (tableau 1). L’augmentation des transports internationaux et l’export d’animaux vecteurs peuvent exposer au risque d’épidémie à distance des foyers habituels d’infection. Une transmission interhumaine est possible pour tous les PXV ; le risque d’infection nosocomiale impose des protections de contact pour tout PXV et un isolement de type gouttelette avec mise en quarantaine pour les OPXV.
Les orthopoxvirus
La variole (VARV)
La campagne de vaccination mondiale de l’OMS a abouti à son éradication officielle en 1980. La variole est actuellement peu enseignée aux étudiants en médecine malgré la nécessité de veille sanitaire (encadré 1, figure 1). Les craintes actuelles des autorités sanitaires portent sur le risque de réémergence naturelle, accidentelle ou intentionnelle du VARV, qui pourrait infecter une part importante de la population mondiale du fait d’une couverture vaccinale insuffisante. La publication dans PlosOne en 2018 des méthodes ayant permis la création synthétique par génétique inversée d’un horsepox virus, antérieurement éteint, a renforcé ces craintes.
Virus de la vaccine (VACV)
Les réserves françaises de vaccins antivarioliques ont été reconstituées après 2011. La vaccination par l’injection d’un VACV atténué (souche lister, 2e génération) ne concerne en France que l’équipe d’intervention nationale et certains laborantins. La vaccination est responsable de réactions locales, attestant de la réussite du vaccin, parfois compliquées par leur intensité, par des surinfections et par des adénopathies régionales (30 %). Les complications plus sévères (encéphalite post-vaccinale, vaccine généralisée, eczéma vaccinatum) étaient exceptionnelles. Des cas d’infection sont toujours rapportés dans l’entourage de personnes vaccinées, notamment aux États-Unis. Des vaccins de 3e génération immunisant contre VARV et les autres OPXV sont maintenant disponibles (virus vivant modifié de la vaccine Ankara) et testés dans certaines zones d’endémie de MPXV. De par sa taille et de son immunogénicité,le VACV connaît d’autre part une utilisation en expansion comme vecteur de thérapie anti-cancéreuse et dans les vaccins recombinants contre d’autres agents infectieux (VIH, Zika, Ebola).
Orthopoxvirus non éradiqués
Le 1er cas d’infection à MPXV a été rapporté en 1970. Il est depuis responsable d’épidémies dans les pays d’Afrique de l’Ouest et d’Afrique centrale (Nigeria, République démocratique du Congo). Les cas notifiés y sont en augmentation ces dernières années suite à une meilleure identification des cas, à la perte de l’immunité antivariolique, et à une possible augmentation de l’exposition aux espèces vectrices (figure 2). Une épidémie a été décrite aux USA en 2003 suite à l’importation d’animaux infectés, ainsi que des cas importés en Angleterre en 2018. Le mode de transmission, les manifestations cliniques et l’évolution sont proches d’une variole ordinaire associant syndrome pseudo-grippal, éruption varioliforme prédominante sur les zones découvertes et atteinte pulmonaire. Une mortalité de 10 % est décrite dans les séries africaines anciennes, mais aucun décès n’a été rapporté lors de l’épidémie américaine. Le CPXV infecte des animaux présents en Europe, surtout à l’est. Son incidence augmente pour les mêmes raisons. Des cas sont rapportés en France. Comme pour le MPXV, l’incubation est d’une semaine. Les lésions sont moins profuses (1 à 10), parfois de grande taille, touchant les zones découvertes. Une dermohypodermite de contiguïté et des adénopathies régionales sont fréquentes. Les formes extensives et les complications respiratoires sont rares. Les ulcérations escarotiques guérissent en 2 à 10 semaines, laissant une cicatrice déprimée. Les autres OPXV sont très rares et les manifestations cliniques identiques au CPXV.
Infection à parapoxvirus
Les parapoxvirus (PPXV) sont transmis à l’homme par contact direct avec des animaux infectés, présentant souvent des lésions péribuccales ou mamelonnaires. Chacun touche des groupes occupationnels distincts (tableau 1). L’orf et le nodule du trayeur, de répartition mondiale, sont les plus fréquents. Le premier est à l’origine d’épidémies annuelles dans les suites d’abattages rituels lors de l’Aïd-El-Kébir (figure 3). Le second entraîne de petites épidémies chez les éleveurs. Les autres PPXV de découverte récente (deerpox virus, sealpox virus) sont rares, le contact de l’Homme avec l’espèce vectrice étant plus rare. Ces zoonoses pourraient être évitées par un renforcement des mesures vétérinaires et une meilleure information des groupes à risque. Les infections à PPXV n’entraînent pas de signes généraux, sauf en cas de surinfection. La transmission interhumaine est très rare. Leur symptomatologie est proche. Après une incubation de 3 à 7 jours, une à quelques lésions apparaissent sur les zones exposées (mains, visage), habituellement vésiculo-bulleuses à base érythémateuse ou violine, de consistance ferme et évoluent vers un aspect en cible puis un nodule ulcéré. La guérison (4 à 8 semaines) peut laisser une cicatrice. Des présentations atypiques, profuses, géantes ou muqueuses sont décrites, notamment chez les patients immunodéprimés ou atopiques.
Molluscum contagiosum virus (MCV)
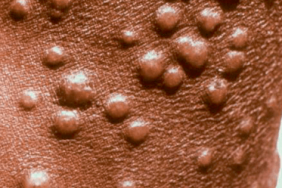
Le MCV est à l’origine de foyers de cas sporadiques chez les enfants, les immunodéprimés, et les jeunes adultes immunocompétents sexuellement actifs. La transmission est le plus souvent interhumaine par contact direct, parfois lors de rapports sexuels, et rarement congénitale ou indirecte via des vecteurs passifs. L’auto-inoculation est fréquente. Après un temps d’incubation de 0,5 à 6 mois, le molluscum contagiosum (MC) se manifeste par de petites papules de couleur chair, fermes, hémisphériques, à surface lisse, de 3 à 5 mm de diamètre, contenant une substance blanchâtre. Une ombilication centrale est évocatrice. De nombreuses présentations atypiques sont décrites. Le nombre de lésions est généralement inférieur à 20 chez l’immunocompétent. Les régions le plus souvent atteintes sont le visage, le tronc et les plis axillaires, ainsi que l’atteinte génitale ou pubienne chez l’adulte. Les formes disséminées (jusqu’à 100 lésions) ou chroniques touchent les patients immunodéprimés ou atopiques. Chaque lésion de MC persiste en moyenne 2 mois et la guérison spontanée de l’ensemble des lésions survient en moyenne en 8 mois. Certaines lésions deviennent eczématiformes avant de disparaître signant la reconnaissance par le système immunitaire malgré les mécanismes multiples d’échappement viral du MCV. Les complications sont la surinfection ou l’eczématisation.
Prise en charge diagnostique des infections à PXV
Le diagnostic de poxvirose est évoqué sur un faisceau d’arguments. Les diagnostics différentiels, d’origine infectieuse ou tumorale, sont nombreux, notamment en cas de forme atypique. La recherche d’éléments cliniques (lésion ferme à contenu non liquidien) et anamnestiques (voyage en zone d’endémie, contact avec animal, fièvre inaugurale) évocateurs est primordiale au diagnostic. Des examens complémentaires peuvent être nécessaires pour confirmer le PXV impliqué, notamment en cas d’infection à OPXV à déclaration obligatoire (MPXV, CPXV, réémergence de VARV). Ainsi, devant une éruption vésiculo-pustuleuse diffuse avec signes généraux, on recherchera à l’examen des signes orientant vers une poxvirose ou vers une varicelle (encadré 2). Devant un nombre restreint de lésions, l’interrogatoire et la présence de signes généraux et d’adénopathies permettront de s’orienter vers une infection à OPXV, à PPXV ou un diagnostic différentiel. Une suspicion d’infection à OPXV constitue une urgence médicale et nécessite une prise de contact avec le centre national de référence sur les OPXV (IRBA, Brétigny-sur-Orge) pour orienter la prise en charge. La dermoscopie peut aider au diagnostic de MC, mettant en évidence des structures blanchâtres/jaunâtres et une fine vascularisation serpentine. Un examen histologique peut être utile, mettant en évidence une hyperplasie épidermique avec des kératinocytes au cytoplasme vacuolisé par des inclusions virales éosinophiles, une parakératose et une prolifération vasculaire de capillaires dilatés associés à un infiltrat inflammatoire polymorphe. Un marquage immunohistochimique par anticorps anti-PXV peut être réalisé. L’identification taxonomique précise du PXV fait appel à l’examen en microscopie électronique d’un prélèvement lésion nel (liquide de bulle, biopsie cutanée) ou de culture virale ainsi qu’à l’étude de l’ADN viral par PCR. Les sérologies virales, réalisées à visées épidémiologiques, sont inutiles chez les patients déjà vaccinés. Les cas d’infection à OPXV (VARV, MPXV et CPXV) nécessitent une déclaration obligatoire à l’InVS.
Traitement des infections à poxvirus
Du fait de sa fréquence et de la durée d’évolution, le MC présente un éventail thérapeutique large. L’efficacité des traitements n’est cependant pas suffisamment étayée scientifiquement pour définir un traitement de première intention selon les dernières revues de la Cochrane. Malgré l’impact du MC sur la qualité de vie, l’abstention thérapeutique peut être envisagée chez l’immunocompétent ayant peu de lésions du fait du risque d’échec des traitements. Parmi les traitements ablatifs physiques, le curetage semble à privilégier et le laser pourrait donner de bons résultats chez les patients avec des éruptions profuses. De multiples traitements topiques sont utilisés (efficacité partielle, niveau de preuve faible). Les traitements topiques les plus courants sont l’hydroxyde de potassium à 10 %, l’acide trichloracétique, l’acide salicylique, sous forme de solutions et l’acide rétinoïque 0,05 %, la podophylotoxine 0,5 % sous forme de crème. L’imiquimod, responsable d’effets indésirables locaux et hématologiques, n’a pas démontré d’efficacité dans 2 essais aux USA ; il ne devrait donc pas être prescrit dans cette indication, notamment chez l’enfant. Des traitements répétés sont parfois nécessaires. Chez les patients immunodéficients ou atopiques, le traitement du MC est souvent difficile. Il repose sur une correction de l’immunosuppression (baisse des immunosuppresseurs, traitement antirétroviral). Le traitement associe généralement des traitements locaux et un traitement antiviral systémique (cidofovir IV, 3-5 mg/kg/semaine). Les autres infections à PXV n’indiquent généralement pas de traitement spécifique. Le traitement consiste en des soins locaux antiseptiques et des antalgiques, associé à une prise en charge des complications hémodynamiques, pulmonaires et des surinfections. Un traitement antiviral par cidofovir ou ribavirine IV pourrait être proposé en cas d’infection sévère à MPXV ou de résurgence de VARV sur le sol français dans le cadre du plan variole.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :
Articles sur le même thème
publicité
publicité